
암은 우리나라 사망 원인 1위인 질병입니다. 보건복지부의 통계에 따르면 암 발생률은 꾸준히 증가하는 추세입니다. 물론, 환자의 5년 생존율도 꾸준히 증가하는 추세이고 조기 발견하는 경우 70% 이상 완치가 가능하다고 하지만, 암은 여전히 무서운 질병입니다.

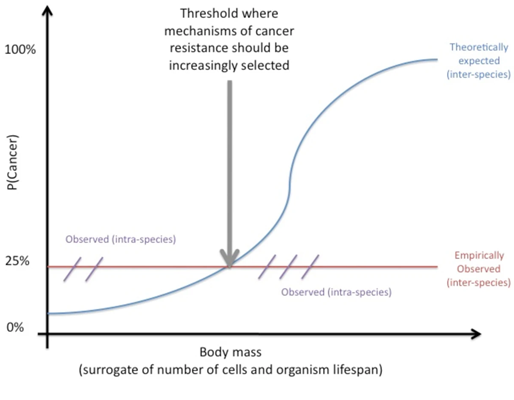
위 [Fig. 1] 이미지와 같이 종 내(intra-species)에서는 신체 질량이 암 발병률과 관계가 있는 것으로 보이지만, 종 간(inter-species)에서는 그렇지 않다는 것이 밝혀졌습니다. 이후 많은 연구진이 페토의 역설에 힘을 실어주는 연구 결과를 발표합니다.
암의 발병 원인은 다양하지만, 세포의 돌연변이 누적이 주원인인 것으로 알려졌습니다. 정상 세포는 세포 주기에 따라 일정한 기간이 지나거나 돌연변이가 누적되면 사멸하게 됩니다. 암세포의 경우 정상 세포와는 달리 누적된 돌연변이에 의해 세포로서 기능하지 못하면서도 사멸하지 않고 지속해서 증식합니다. 이 과정에서 정상 세포를 밀어내고 다른 세포들이 사용해야 할 영양분을 흡수하면서 신체에 문제를 일으킵니다. 영양분 흡수가 쉽지 않으면 자체적으로 혈관을 생성(Angiogenesis)해서 영양분을 수급하는데, 이러한 혈관은 암 전이를 쉽게 하는 역할을 하기도 합니다.
암은 세포의 돌연변이 누적으로 발병하기 때문에 이론상으로 모든 생물이 암에 걸릴 수 있습니다. 심지어 기생충에게도 암이 발병하며, 수천만 년 전 지구에 생존했던 공룡의 화석에서도 암에 걸렸던 흔적이 발견되기도 합니다.

1977년, 영국의 통계학자이자 역학자인 리차드 페토는 흥미로운 연구 결과를 발표합니다. 리차드 페토는 세포의 돌연변이 누적으로 암이 발병하는 거라면, 생물의 사이즈가 크고 수명이 길수록 암 발병률이 높을 것이라는 가설을 세웁니다.
본인의 가설을 바탕으로 실제 사람과 쥐의 암 발생률에 관한 연구를 합니다. 사람과 쥐는 세포 수는 약 1,000배, 수명은 30배 정도 차이가 나기 때문에, 암 발생률도 양의 상관관계 (positive correlation) 가 있을 것으로 예측했습니다. 그는 쥐나 사람이나 암 발생률은 비슷하다는 것을 발견함으로써 그의 가설이 틀렸음을 알게 됩니다. 이러한 현상을 발견한 페토는 이를 “페토의 역설 (Peto’s paradox)” 라고 명명합니다.
그는 이 현상을 인간이 신체 사이즈가 커지고 수명이 늘어나는 방향으로 진화하는 과정에서 암 발생을 억제하는 메커니즘 또한 함께 진화했기 때문일 것이라고 설명합니다.

[Fig. 1] 페토의 역설 요약
위 [Fig. 1] 이미지와 같이 종 내(intra-species)에서는 신체 질량이 암 발병률과 관계가 있는 것으로 보이지만, 종 간(inter-species)에서는 그렇지 않다는 것이 밝혀졌습니다. 이후 많은 연구진이 페토의 역설에 힘을 실어주는 연구 결과를 발표합니다.
가장 대표적인 예는 2015년에 발표된 Schiffman 연구진의 연구결과입니다. 2015년 유타 대학교의 Schiffman 교수 연구진들이 San Diego 동물원의 쥐, 코끼리 등을 포함한 36종의 포유동물을 부검해서 암에 의한 사망률을 조사합니다. 이들은 종간 신체 크기나 수명 등은 암 발병률과 통계적으로 상관관계가 없음을 발표합니다.
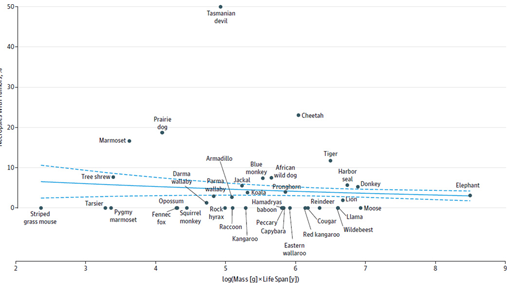
[Fig. 2] 36개의 포유동물의 암 발병률
위 그래프를 통해 종의 수명이나 크기는 암 발병률과 상관관계가 없음을 확인할 수 있습니다. 더불어, 암 발생률이 낮은 다른 종의 암 억제 메커니즘을 밝혀내는 연구도 활발하게 이루어지고 있습니다. 대표적으로 암 발생률이 5% 내외로 알려진 코끼리가 있습니다. 앞서 언급된 Schiffman 교수 연구진과 시카고대학교 Lynch 교수의 연구진이 2015년에 발표한 두 연구 결과에 의하면 코끼리는 암 억제 유전자로 알려진 TP53 유전자를 사람보다 더 많이 보유한 것으로 밝혀졌습니다.
포유류 대부분이 보유하고 있는 TP53 유전자는 사람의 경우 유전자가 하나이지만, 코끼리의 경우 20개를 가진 것으로 확인되었습니다.
TP53 유전자는 DNA가 손상된 세포의 복구나 세포자살을 유도하는 역할을 하는 것으로 알려졌습니다. 실제, Li-Fraumei syndrome(LFS) 라는 질병은 TP53 유전자 결함에 의해 발병하게 되는데, 이 환자의 경우 각종 암에 걸릴 확률이 매우 높습니다. 코끼리의 TP53 유전자의 경우 손상 세포의 복구보다는 손상 세포를 소멸시키는 메커니즘에 적극적으로 관여하는 것으로 알려졌습니다.
2018년, 시카고 대학의 Lynch 교수 연구진은 코끼리가 가지는 또 다른 항암 메커니즘을 밝혀냅니다. 코끼리에서 특이적으로 발현하는 LIA 6 라는 유전자입니다. 이 유전자도 TP53 유전자에 의해 활성화되어 DNA가 손상된 세포 사멸을 유도하는 유전자로 밝혀져 있습니다. 연구진은 이 유전자를 좀비 유전자라고 칭하는데, 수천만 년 전까지 위유전자(pseudogene)로 존재하던 LIF 유전자 중 하나인 LIF6 유전자가 진화과정 중 발생한 변이 때문에 TP53 유전자로 인해 활성화되었기 때문입니다.
TP53 유전자는 DNA가 손상된 세포의 복구나 세포자살을 유도하는 역할을 하는 것으로 알려졌습니다. 실제, Li-Fraumei syndrome(LFS) 라는 질병은 TP53 유전자 결함에 의해 발병하게 되는데, 이 환자의 경우 각종 암에 걸릴 확률이 매우 높습니다. 코끼리의 TP53 유전자의 경우 손상 세포의 복구보다는 손상 세포를 소멸시키는 메커니즘에 적극적으로 관여하는 것으로 알려졌습니다.
2018년, 시카고 대학의 Lynch 교수 연구진은 코끼리가 가지는 또 다른 항암 메커니즘을 밝혀냅니다. 코끼리에서 특이적으로 발현하는 LIA 6 라는 유전자입니다. 이 유전자도 TP53 유전자에 의해 활성화되어 DNA가 손상된 세포 사멸을 유도하는 유전자로 밝혀져 있습니다. 연구진은 이 유전자를 좀비 유전자라고 칭하는데, 수천만 년 전까지 위유전자(pseudogene)로 존재하던 LIF 유전자 중 하나인 LIF6 유전자가 진화과정 중 발생한 변이 때문에 TP53 유전자로 인해 활성화되었기 때문입니다.
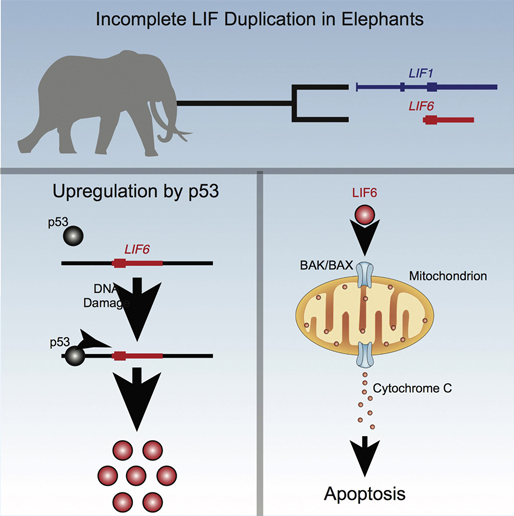
[Fig. 3] 코끼리의 LIF6 유전자의 세포자살 유도 메커니즘
이외에도 암에 거의 걸리지 않는 것으로 알려진 벌거숭이두더지쥐나 고래 등도 주요 연구 대상 중 하나입니다. 두 종 모두 노화 정복을 위해 연구하는 연구자들 사이에서 주목받는 종이기도 합니다.

일부 연구자들은 여전히 이 이론에 의문을 품고 있지만, 페토의 역설은 오늘날 암을 정복하기 위한 하나의 방향으로 받아들여지고 있습니다. 구글 자회사인 캘리코 사에서는 현재 생명연장 프로젝트에서 벌거숭이 두더지쥐에 관한 연구를 진행 중이고, 코끼리의 항암 메커니즘을 밝혀냈던 두 연구자는 이를 응용하여 코끼리의 항암 단백질을 이용한 암 치료제 개발을 위한 신생기업 기업을 세웠습니다.
사람 이외의 동물들에 대한 항암 메커니즘에 관한 연구들은 여전히 시작단계이고, 밝혀진 부분보다는 밝혀져야 할 부분들이 많겠지만, 언젠가 이 연구들이 성과를 보는 날을 기대해 봅니다.

- Viviane Caliier, 2019, Solving Peto’s Paradox to better understand cancer. PNAS.
- Marc Tollis et at., 2017. Peto’s Paradox: how has evolution solved the problem of cancer prevention?. BMC Biology.
- Lisa et al., 2016. Potential Mechanisms for Cancer Resistance in Elephants and Comparative Cellular Response to DNA Damage in Humans. JAMA
- 박수경, “[캔서앤서 A to Z] 암, 정체가 뭐지? 왜 생기는거지?”, <CANCER ANSWER>
- 엄남석, “코끼리에게서 암 정복 길을 찾다.. ‘좀비유전자’ 규명”, <연합뉴스>
작성 : BS실 박서우 주임개발자
Posted by 人Co
- Response
- No Trackback , No Comment
- RSS :
- https://post-blog.insilicogen.com/blog/rss/response/357
Trackback URL : 이 글에는 트랙백을 보낼 수 없습니다


